Vous avez tous déjà entendu parler du fameux tableau périodique des éléments ou table de Mendeleïev pendant vos cours de physique . Indéchiffrable au premier abord, nous allons voir que ce tableau regorge d’informations très intéressantes sur les atomes !
Le tableau périodique plein de cases pour les éléments !
Ce tableau est constitué de 118 cases, dont chacune représente un élément chimique. De nombreuses informations sur ces atomes sont indiquées dans le tableau périodique.
Chaque atome se caractérise par un nombre précis de protons, appelé numéro atomique Z. Les protons sont des éléments chargés positivement, constitutifs du noyau atomique. Cependant, un atome est naturellement neutre, c’est-à-dire sans charge électronique, c’est pourquoi des électrons chargés négativement gravitent autour du noyau. Des neutrons, non chargés, peuvent aussi faire partie du noyau et lui conférer une stabilité, plus ou moins importante, en fonction de leur nombre.
L’atome d’hydrogène est formé d’un proton et d’un électron, mais d’aucun neutron. Son numéro atomique est donc de 1. Les atomes étant rangés dans le tableau périodique dans l’ordre de leur numéro atomique, l’atome d’hydrogène apparait en haut à gauche du tableau.
Un atome est aussi identifiable par un nom complet ainsi qu’un symbole. Ce dernier est formé par une lettre majuscule au minimum, suivie parfois d’une lettre minuscule.
Certains symboles sont plus faciles à retenir que d’autres, car sont simplement la ou les premières lettres du nom complet : c’est le cas de l’hélium He ou du carbone C. Cependant, pour d’autres, il est plus difficile de faire le rapprochement : Na pour le sodium ou encore Au pour l’or. Cela provient du fait que les symboles ont été tirés du néolatin de l’époque moderne : aurum pour l’or, d’où le symbole Au et natrium pour le sodium, d’où Na. Avec un peu de pratique, le Pb sera pour vous le plomb et le K le potassium !
Le tableau périodique indique aussi la masse atomique de l’élément. Cette masse est calculée en fonction de la masse des neutrons et des protons de l’atome et s’exprime en unité de masse atomique qui correspond à environ 1,66 x 10-27 kg.
Prenons l’exemple du calcium. Cet atome a un numéro atomique égal à 20, donc possède 20 protons. Sa masse atomique est de 40,078 unités de masse atomique et son symbole est Ca.
Pour le calcium, le nombre de neutrons est variable, mais l’atome le plus stable en possède 20. Certains atomes de calcium possèdent 22 ou 24 neutrons : ce sont différents isotopes. Les isotopes d’un atome varient uniquement par leur nombre de neutrons, ils ont le même nombre d’électrons. Pour calculer la masse atomique, la quantité relative de chaque isotope est prise en compte.
Chaque case s’organise dans le tableau, dans des lignes et des colonnes particulières, qui ont une signification importante concernant les propriétés chimiques et électroniques des différents éléments.
Les lignes du tableau périodique sont les périodes des éléments
Chaque ligne du tableau est appelée période et indique la configuration électronique des atomes. Le tableau périodique est constitué de sept lignes, numérotées dans l’ordre croissant de bas en haut en chiffres latins.
Les électrons gravitant autour du noyau s’organisent en couches successives (une couche est saturée quand elle contient 8 électrons ou 2 électrons, dans le cas de la première couche).
Nous pouvons remarquer que le numéro de la période correspond au nombre de couches électroniques que possède ses atomes : les atomes de la première période possèdent une couche électronique nommée (K), ceux de la deuxième période possèdent deux couches électroniques (K) et (L), ceux de la troisième possèdent les couches (K), (L) et (M)…
La première couche électronique ne peut contenir que deux électrons, c’est pourquoi il n’y a que deux éléments sur la première ligne du tableau : l’hydrogène avec un électron et l’hélium avec deux électrons (couche électronique remplie).
Le remplissage de ces couches détermine la réactivité et les propriétés chimiques des atomes. Des éléments d’une même période ont une masse atomique proche, mais une réactivité très différente. Ce sont donc les colonnes qui regroupent les atomes ayant des propriétés proches.
Les colonnes du tableau périodique regroupent des familles d’éléments
Le tableau périodique est constitué de 18 colonnes, dont les deux premières et les six dernières sont des familles chimiques (notées en chiffres romains dans l’ordre croissant, de gauche à droite) et toutes les colonnes intermédiaires contiennent des éléments de transition. Les familles chimiques contiennent des atomes possédant des propriétés similaires. En effet, celles-ci sont déterminées par le nombre d’électrons qu’ils ont dans la couche électronique la plus éloignée du noyau, les électrons de valence, qui est identique, dans une même colonne.
– La première famille contient les alcalins, comme le lithium ou le potassium (le nom des piles alcalines vient d’ailleurs du fait que de l’hydroxyde de potassium y est utilisé comme substance conductrice). Ces atomes sont très réactifs et possèdent un électron de valence, c’est pourquoi on les retrouve souvent sous forme chargée : Li+, Na+ ou H+ sont des atomes ayant cédé leur électron de valence (ils ont perdu une charge négative et se chargent donc positivement).
– La seconde famille contient les alcalino-terreux, comme le magnésium. Ils possèdent deux électrons de valence, qu’ils peuvent céder pour augmenter leur stabilité : c’est ainsi qu’on retrouve souvent le magnésium sous forme Mg2+ ou le calcium sous forme Ca2+.
– Les familles III à VI (correspondant aux colonnes 13 à 16) se nomment comme le premier atome de la colonne : famille du bore, du carbone, de l’azote et de l’oxygène et possèdent respectivement trois, quatre, cinq et six électrons de valence.
– La famille VII contient les halogènes, possédant sept électrons de valence. Afin de gagner en stabilité, ils captent souvent un électron : le chlore se retrouve sous forme Cl– et l’iode sous forme I–.
– La dernière famille est celle des gaz rares (ou gaz nobles ou inertes) qui possèdent une couche électronique de valence saturée (c’est à dire qu’ils respectent la règle du duet de et l’octet et ont ainsi 2 ou 8 électrons dans leur couche la plus externe), ce qui les rend très peu réactifs. L’hélium ou encore le néon en font partie.
Les familles chimiques regroupent ainsi des atomes ayant des propriétés de conductivité, mais aussi de fusion ou des réactivités semblables.
Apprendre les éléments du tableau périodique
Régulièrement dans la scolarité, les professeurs demandent d’apprendre au moins en partie le tableau périodique… dans l’ordre ! Comment faire ?
La technique la plus répandue est d’apprendre des phrases mnémotechniques pour chaque période du tableau. Certaines phrases sont très connues et classiques, mais il est souvent plus efficace de trouver sa propre phrase. Il faut se motiver à apprendre ces phrases et normalement tout devrait être plus simple ensuite.
Pour les trois premières périodes, voilà les phrases classiques :
1) Ho Hé (Hydrogène – Hélium)
2) Lilly Bêcha Bien Chez Notre Oncle François-Nestor (Lithium Li – Béryllium Be – Bore B – Carbone C – Azote N – Oxygène O – Fluor F – Néon Ne)
3) Napoléon Mangea Allègrement Six Poulets Sans Claquer d’Argent (Sodium Na – Magnésium Mg – Aluminium Al – Silicium Si – Phosphore P – Soufre S – Chlore Cl – Argon Ar)
Mais aussi des phrases moins classiques :
1) Hurley Hello (Hydrogène – Hélium)
2) Libère le Berceau de Bébé, Car Nouméa Oublie Fréquemment Néo (Lithium Li – Béryllium Be – Bore B – Carbone C – Azote N – Oxygène O – Fluor F – Néon Ne)
3) Nimage Monologua Allègrement, Simplement Parce que Snoball Clos son Argumentation (Sodium Na – Magnésium Mg – Aluminium Al – Silicium Si – Phosphore P – Soufre S – Chlore Cl – Argon Ar)
Ne vous inquiétez pas si les phrases ne veulent pas dire grand-chose, du moment que vous les retenez, vous avez gagné ! Il faut juste avoir de l’imagination !
Et vous, connaissiez-vous ce fameux tableau périodique et toutes les informations qu’il contient ? Avez-vous déjà eu à l’apprendre et avez-vous imaginé des phrases drôles pour cela ? Elles sont bien la preuve qu’on peut apprendre tout en s’amusant même après la maternelle !
Ursuline
Sources images :
– Image 1



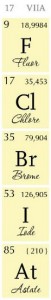





Piiix, le 05/02/2013 à 18:58
Ah que j’aimais ces cours moi *.* Structures des atome, chimie quantique *.*
Et sinon les memotechnique de la fin ….xD
Jorkane, le 06/02/2013 à 00:37
En physique, vraiment ? Moi, j’en suis une habituée… mais en chimie ! Enfin, bref, rien de bien nouveau pour moi, cela dit c’est très bien expliqué ! Heureusement, je n’ai jamais eu à apprendre le tableau par coeur, même si à force de l’utiliser on en vient à se souvenir de certains éléments qui reviennent plus souvent que d’autres… :p
Nimage, le 08/02/2013 à 19:45
Bon, je radote, certes, mais OMG, cet article est génial *.*
Ursuline, le 31/03/2013 à 14:59
T’as vu comment ils gères mes moyens mnémotechniques à la fin Piiixou héhé
Jorkane, c’est vrai que c’est peut être plutôt chimie, en fait comme on a une matière « physique-chimie » je n’ai pas vraiment réfléchi à ça ! Merci !
Merci Nimage !
Tony, le 27/06/2013 à 19:36
Les mnémotechniques il n’y a que ça de vrai. 🙂
Ça n’a pas vraiment de rapport, mais sinon en grand classique des mnémotechniques il y a aussi : « Ne Mangez Rien Ou Jeunez Voilà Bien Votre Grande Bêtise ».
Qui saura trouver à quoi ça correspond?